Cтарение. Часть II Портрет врага. Молекулы. Клетки.Ткани: Борьба кланов. Микробы. Иммунитет. Гормоны.Кровь: Переливание молодости. Возрастные заболевания. Биологический возраст
Часть II Портрет врага
Попробуем разобраться в том, как меняется со временем жизнь и работа отдельных составляющих нашего тела. Видеоконспект https://youtu.be/dsvNYHZCHqg

Электронная книга t.me/kudaidem/1038
Часть 1 https://smart-lab.ru/blog/628950.php
Обри ди Грей сравнивает организм человека с автомобилем, и я тоже буду говорить о борьбе со старением как о ремонте.
Начнем с молекул и клеток – выясним, как они изменяются с возрастом и можно ли этому противостоять. Можем ли мы, иными словами, пересобрать человека так, чтобы он перестал стареть?
В человеческом теле изменения тоже не ограничиваются старением клеток, а затрагивают все уровни организации, поэтому, стартовав с молекул и клеток, мы будем шаг за шагом подниматься выше, к группам клеток, органам и системам органов.
Чем разнообразнее эти лики старости, тем сложнее и интереснее искать против них оружие.
1. Молекулы: Мусорная катастрофа
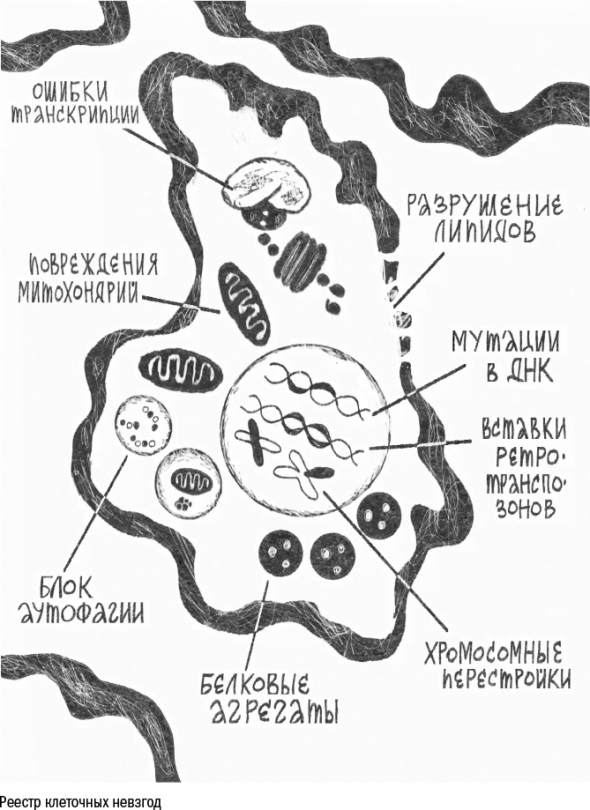
Клетка, как и мы, страдает от мусорной катастрофы – старение внутри нее проявляется в виде испорченных молекул: жиров, белков и ДНК.
Пятна на ДНК
Рассказ о внутриклеточном мусоре я начну с мутаций в ДНК.
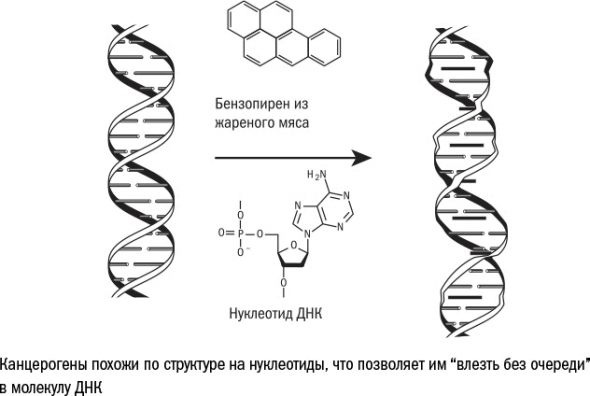
Чаще всего это замена одного нуклеотида («буквы») на другой. Но бывает и по-другому: в тексте гена могут появиться новые «буквы» (инсерция), а также исчезнуть (делеция) или поменяться местами (инверсия) уже существующие.
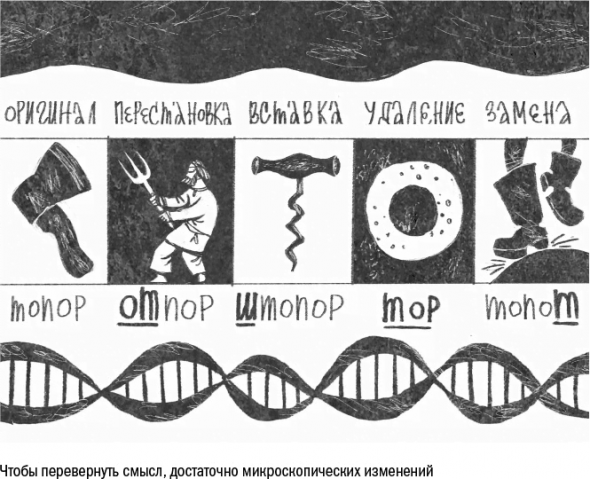
Точечные мутации – это в некотором роде неудачные попытки клетки справиться с поломками в ДНК. Рис 28
Мутации в конечном счете приводят к тому, что клетка теряет способность делиться или – если система репарации не успела забить тревогу – становится раковой.
Вот приблизительный список тех, кто ответственен за первичные поломки:
- Ультрафиолетовые лучи
2. Канцерогены. Так действует на клетку, например, курение: при сгорании смолы образуются канцерогенные полициклические углеводороды. Примерно то же самое происходит при жарке красного мяса. наблюдения за жителями полуофициальной «голубой зоны» – общины церкви адвентистов седьмого дня – показывают, что даже одна сосиска в день увеличивает риск смерти от всех причин на 6 %.
4. Кислород активные формы кислорода работают как химический окислитель, отбирая электроны у других молекул.
Мутации в митохондриальной ДНК некоторые ученые называют причиной многих возрастных синдромов
5. Ошибки копирования. даже если один раз на миллион белок проведет реакцию с неподходящим нуклеотидом, в клетке появится несколько тысяч новых мутаций.
К счастью, полимеразы умеют вовремя останавливаться и исправлять ошибки: вырезать неверный нуклеотид и проводить реакцию заново. Но и этот механизм иногда дает сбой, и неподходящий нуклеотид остается на месте. Тогда за дело берутся белки репарации, которые тоже время от времени ошибаются – в этом случае ошибка закрепляется в ДНК.
Мутации в ДНК, как и пятна на обоях, возникают неизбежно.
чем старше женщина, тем выше риск образования яйцеклеток с лишними, дополнительными или перестроенными хромосомами – а из них после оплодотворения получаются анеуплоидные зародыши.
Для большинства наших клеток анеуплоидия губительна.
Белковая пыль
Белки – вторые по длине молекулы в клетке после ДНК. В некотором смысле их тоже можно воспринимать как текст: подобно тому, как ДНК складывается из отдельных букв-нуклеотидов, белок строится из слов-аминокислот.
Испорченные белки могут появиться в результате ошибки сборки. Подобно системе копирования ДНК, молекулярная машина, которая синтезирует белки, – рибосома – не работает безупречно.
Точность работы рибосомы в каждом организме — это постоянная характеристика. А вот у разных видов точность может различаться. Самыми аккуратными оказываются (кто бы сомневался!) рибосомы голого землекопа, а также других долгоживущих грызунов: слепыша, американского бобра и серой белки.
если системы уборки мусора работают медленнее, чем он появляется, то клетка постепенно начинает функционировать все хуже и хуже. А с возрастом активность «коммунальщиков» часто становится ниже.
Среди ненасыщенных жирных кислот две группы для человека считаются незаменимыми, поскольку наш организм не может их произвести самостоятельно. Первая группа – это омега-3 кислоты, например линоленовая кислота. Их молекулы содержат три двойные связи, мы получаем их в основном из рыбы и морепродуктов. Вторая группа – омега-6 кислоты: линолевая кислота и ее родственники. В них по две двойные связи, а основной их источник – растительные масла.
На молекулярном уровне старение выглядит как накопление мусора в разных его формах – от белковых клубков и изломанных липидов до пятен на ДНК.
Количество мутаций с возрастом постепенно растет, и в какой-то момент скорость их накопления обгоняет скорость ремонта.
Преимущество получили те, кто усовершенствовал свои навыки ремонта.
Но, перед каждой клеткой встает дилемма: имеет ли смысл тратить силы на поддержание своих клеток в чистоте или, возможно, стоит направить энергию на размножение?
большинство организмов решили для себя эту дилемму следующим образом: они оставили себе «неприкосновенный запас» клеток, с помощью которых будут размножаться, и в них стараются поддерживать чистоту и порядок. А остальным клеткам – в нашем случае всему остальному телу – энергия достается по остаточному принципу.
2. Клетки: Между жизнью и смертью
В нашем организме немало клеток, которым столько же лет, как и всему остальному телу. Чаще всего в пример приводят нервные клетки, которые практически не размножаются после появления человека на свет.

Встречается термин «сенесцентная клетка», но чаще говорят о «старых» или «стареющих» клетках.
Сенесцентные клетки накапливаются при ожирении, деменции. Поэтому их количество может свидетельствовать скорее об общем здоровье организма, чем о его хронологическом возрасте.
Зрелые клетки, как правило, не делятся, почти не растут (кроме жировых и других запасающих клеток) и не способны изменить своему призванию.
Но есть и другие клетки, которые не проводят свои дни за работой. Это, например, стволовые клетки, они заняты размножением.
Выбор: остаться стволовой или уйти в дифференцировку – важная развилка в жизни каждой клетки.
В большинстве случаев естественная смерть клетки наступает посредством апоптоза. Его еще называют программируемой клеточной гибелью или клеточным самоубийством.
Клетка может постареть практически на любом этапе своей жизни, будь она примерным семьянином (стволовая), успешным профессионалом (дифференцированная), отъявленным бандитом (раковая) или подростком (недавно отделившаяся от материнской).
Для этого нужен сильный стресс. Под действием стресса клетка перестает выполнять прежние функции и приносить пользу клеточному сообществу.
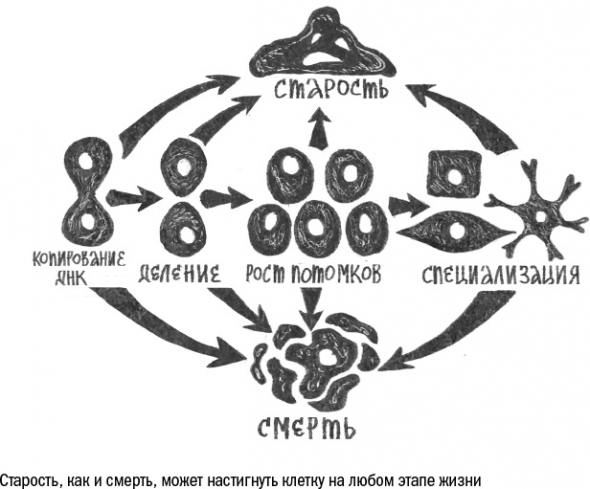
Система клеточного самоубийства имеет множество полезных функций в организме. Помимо расчистки места для новых клеток, она позволяет также уничтожить потенциально опасные клетки, которые могут потом превратиться в опухолевые.
Старческий консерватизм
Следующий признак старой клетки – неспособность учиться новому. Иными словами, она не может воспользоваться собственной генетической информацией.
Потеря памяти
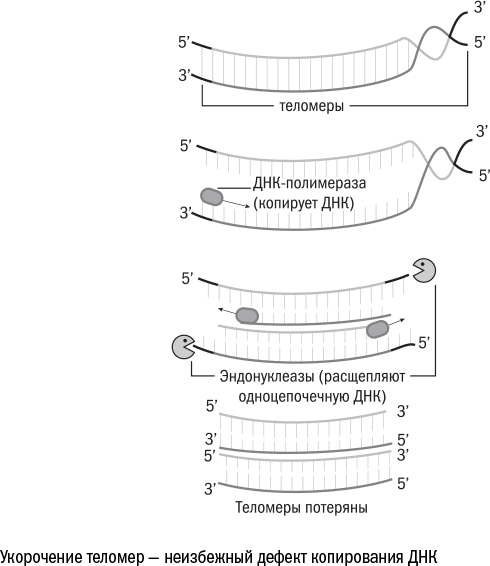
С возрастом ДНК не просто перестраивается, но и становится короче. Каждая из 46 наших хромосом – это отдельная нить, по краям которой находятся особые участки – теломеры. При каждом делении клетки небольшой кусочек теломер теряется. Это связано с тем, что полимеразы – белки, которые копируют ДНК, – не могут начать строить вторую цепочку с самого края, им необходимо сначала закрепиться и взять разгон.
Кончик молекулы, на который крепилась РНК, остается неудвоенным. Одиночные цепи ДНК в клетке долго не живут: их распознает система противовирусной защиты, принимая за кусок чужеродного генома, и уничтожает. Так хромосома становится короче.
После определенного количества делений теломеры заканчиваются, и под угрозой исчезновения при копировании оказываются настоящие, «содержательные» гены. В этот момент клетка перестает размножаться, чтобы не лишиться ценной информации и не наплодить потомков-мутантов, – и становится сенесцентной.
Даже активно размножающиеся клетки теряют эту способность примерно после 50 раундов деления. Это пороговое значение получило название предела Хейфлика. То есть за 50 циклов размножения теломеры становятся критически короткими и клетка стареет. Поэтому клеточный возраст можно оценивать и по длине теломер.
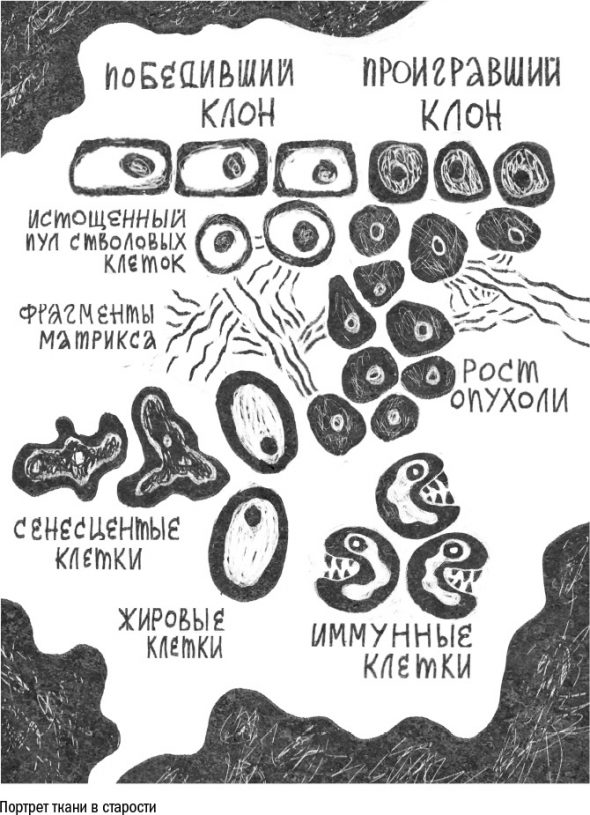
Подобно многим пожилым людям, сенесцентные клетки любят давать советы – то есть выделять вещества, воздействующие на окружающих.
Этот набор советов серьезно вредит соседним клеткам и ткани в целом. Межклеточное вещество разрушается, в ткани образуются дыры, клетки начинают делиться – и превращаются в опухоли, а иммунные клетки развязывают настоящую войну. Они заползают в ткань, чтобы уничтожить старые клетки, но в процессе борьбы с ними выделяют множество токсичных веществ. Это приводит к тому, что соседние клетки начинают себя чувствовать неуютно (испытывают стресс) и тоже стареют. По ткани прокатывается эпидемия старости.

Исходя из этого, кажется, что верным способом борьбы со старением мог бы быть избирательный отстрел сенесцентных клеток. Такие методы действительно существуют, я еще расскажу о них подробно в третьей части.
Проблема только в том, что старые клетки в ткани – как и пожилые люди в человеческом обществе – играют свою немаловажную роль.
Поэтому запретить их раз и навсегда не получится, а значит, придется искать какие-то другие способы смириться с их существованием.
3. Ткани: Борьба кланов
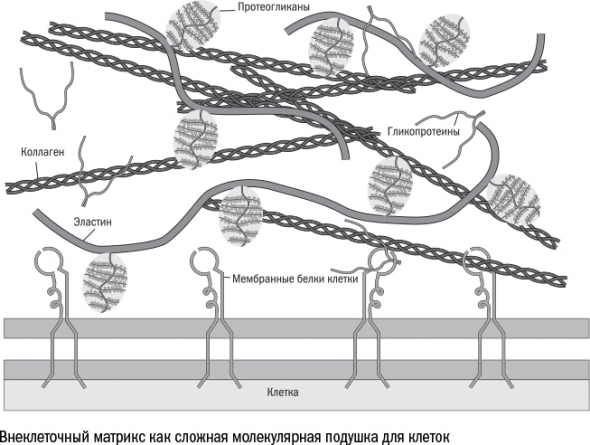
Клетка внутри организма полностью зависима от своего микроокружения, или ниши, – межклеточного вещества и ближайших соседей.
Как только организм строит себе внеклеточный скелет – что, конечно, прочно и выгодно, – его срок жизни начинает напрямую зависеть от сохранности скелета. И встает вечный вопрос многоклеточных существ: на что потратить энергию – на размножение или ремонт своей несущей конструкции?
Несмотря на то что каркасные белки матрикса и без того обновляются редко – время полужизни молекулы коллагена в коже составляет около 15 лет, – стареющие клетки производят его все меньше и меньше. Вместо этого они выделяют белки SASP («вредные советы»), среди которых немало ферментов для разрушения матрикса.
Нарастающий с возрастом в ткани хаос на руку клеткам опухоли: разрушенные волокна больше не тормозят их движение и размножение. Таким образом старый матрикс стимулирует развитие опухолей.
Люди, пережившие противоопухолевую терапию, стареют быстрее других.
могло бы стать хорошей стратегией омоложения – очищать матрикс от накопленного мусора или просто вводить новые, не тронутые временем молекулы. Однако тесная связь между клетками и межклеточным веществом мешает «омолодить» всю ткань разом.
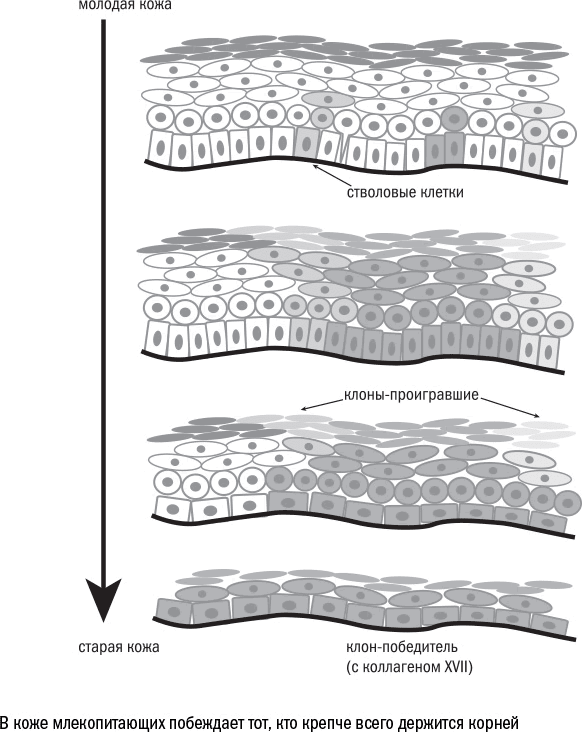
Среди множества клеток в ткани есть и те, чье старение особенно опасно, – это стволовые клетки.
Жизнь стволовых клеток устроена следующим образом: по умолчанию – покой, по сигналу – деление. Чаще всего клетки делятся асимметрично, то есть одна остается стволовой, а другая становится клеткой-предшественником, то есть активно размножается, поставляя новобранцев в клеточные ряды.
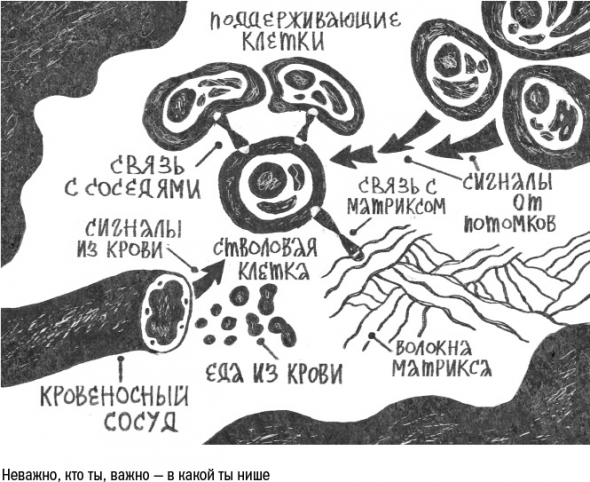
одна из проблем, которая настигает многие ткани в старости: за свою жизнь человек переносит немало болезней и травм, которые заставляют стволовые клетки делиться симметрично.
Сами по себе стволовые клетки в большей степени устойчивы к старению, чем их потомки. В состоянии покоя они производят меньше свободных радикалов, синтезируют меньше белков и не копят внутриклеточный мусор, да и аутофагия у них работает эффективнее. Но стоит им «проснуться», как обмен веществ ускоряется, начинается деление, и поломок в клетке становится больше.
На первый взгляд стволовые клетки могут показаться многообещающим средством борьбы со старостью. Они стали частью стратегии Обри ди Грея.
Идея проста: коль скоро тканевые резервы иссякают, а выращивать новые органы мы, за редкими исключениями, пока не умеем, то можно просто ввести в организм стволовые клетки, и они сами заменят изношенные ткани.
Проблема в том, что для того, чтобы клетки не вызвали иммунного ответа, они должны принадлежать самому пациенту. То есть необходимо забрать собственные клетки у человека, размножить их и вернуть обратно. Но чем старше становится человек, тем меньше у него клеток, которые еще способны размножаться.
Только около 1 % стволовых клеток реально участвует в восстановлении ткани, а к 80 годам больше половины из них превращаются в сенесцентные. Поэтому добыть нужное количество, скорее всего, не получится или будет очень сложно.
В клеточном государстве встречается откровенная агрессия – клеточная конкуренция (cell competition), в ходе которой более крепкие и сильные клетки выживают из ткани слабых.
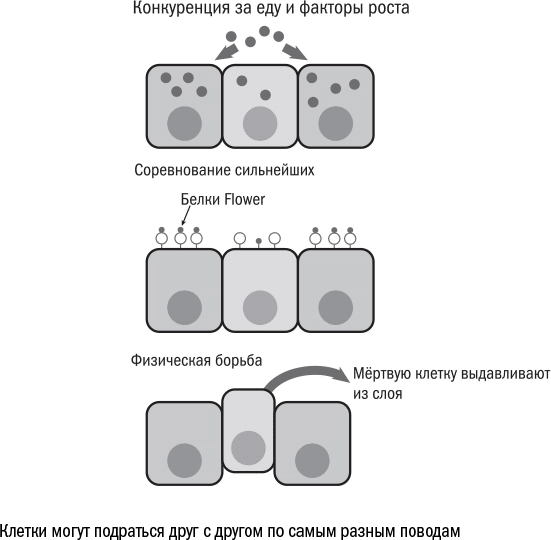
Борьба молодых клеток против старых может лежать в основе нейродегенеративных заболеваний, например болезни Альцгеймера.
Но, ситуация выглядит парадоксальной: когда мы запрещаем клеткам умирать, они гибнут быстрее. Вероятно, дело в том, что клеточная конкуренция очищает ткань от ослабленных и немощных клеток, а остальные за счет этого получают доступ к ресурсам и дополнительный шанс выжить.
У молодых людей есть два основных места, где можно найти жировую ткань: подкожная клетчатка и брюшной (висцеральный, он же абдоминальный) жир. С возрастом подкожная клетчатка становится тоньше, а брюшной жир, наоборот, толще. По некоторым данным, отношение объема талии к окружности бедер(чем выше, тем больше абдоминального жира) позволяет лучше предсказать риск умереть, чем индекс массы тела, то есть является в некотором роде признаком старости.
Экспансия жира вызывает, с одной стороны, ожирение органов, которое мешает им работать в полную силу. В то же время, расселившись по всему телу, жир продолжает стареть – в нем накапливаются сенесцентные клетки, которые разрушают внеклеточный матрикс и выделяют «заразные» белки SASP. В недавнем эксперименте ученые откормили мышей до ожирения – и после этого даже в мозге у них выросло количество сенесцентных клеток с жировыми каплями внутри.
При избыточной массе тела даже у молодых людей в жировой ткани накапливается гораздо больше (иногда в 30 раз) сенесцентных клеток, чем у здорового человека.
Поэтому в некотором смысле ожирение можно считать ускоренным старением, по крайней мере на тканевом уровне. В связи с этим не кажется удивительным тот факт, что ожирение повышает риск развития множества других возрастных болезней, начиная с диабета и заканчивая атеросклерозом, инфарктом, инсультом и раком.
Остановить клеточную конкуренцию невозможно. Заблокировать ее искусственно мы можем, но ни в одном из экспериментов это не приводит к ожидаемым улучшениям.
4. Микробы: Революция в кишечнике
Симбиотические бактерии человека – неоднозначные создания. Когда-то их считали источником неприятностей и болезней. Потом догадались, что они выполняют полезную работу, например помогают переваривать еду.
Наш организм – многонациональная клеточная федерация, и собственные клетки человека в ней даже не формируют большинство.
Каждый из нас носит в себе триллионы бактерий. Человека разлучить с бактериями невозможно.
Большинство наших микроскопических соседей живут в дальних отделах кишечника, толстой и прямой кишке. Это неспроста: бактерии – создания корыстные и селятся там, где хорошо кормят

Взамен микробы откупаются целым списком добрых дел. Они помогают переваривать молекулы, с которыми не справляются наши пищеварительные ферменты (например, растительные углеводные волокна), производят витамины (К и некоторые из группы В), которые организм человека не умеет синтезировать сам, и защищают нас от других, патогенных бактерий.
Микробы и их люди заключили взаимовыгодный пакт о ненападении: они нас защищают, мы их не выгоняем.
Человек тоже не выживет без своих микробов – без их витаминов, продуктов расщепления еды и сигнальных веществ. Именно поэтому сегодня так много медицинских исследований посвящено пересадкам кишечных бактерий как способу справиться с самыми разными болезнями.
От каких именно микробов зависят жизнь и здоровье человека, до сих пор неясно.
Известно, например, что микробиом связан с местом жизни человека: даже в пределах одной страны по содержимому кишечника можно распознать уроженцев разных регионов. Возможно, в этом как-то замешан тип питания – второй важный фактор, который определяет состав кишечных бактерий. Каждый микроб приспособлен к определенному типу пищи.
На бактериальный состав кишечника влияют люди, с которыми мы контактируем. Недавно, изучая крестьян на Филиппинах, исследователи натренировали компьютерный алгоритм предсказывать по набору бактерий, кто с кем состоит в браке.
Все эти факторы – место жительства, еда, количество гормонов и контакты с соседями – действуют одновременно, делая микробное сообщество внутри каждого человека неповторимым и заставляя его постоянно меняться.
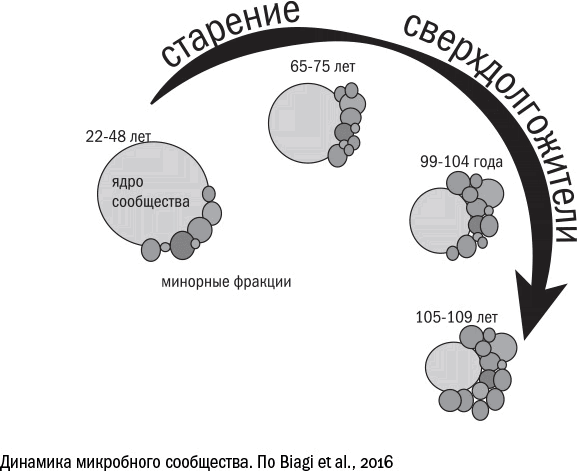
С возрастом, микробная толпа в кишечнике становится гораздо более разнообразной и прежняя олигархия уступает место демократии.
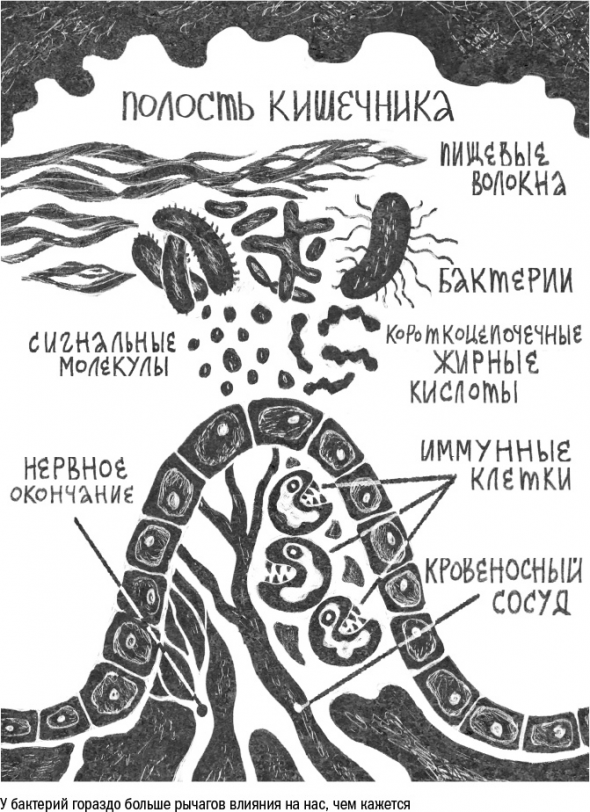
Чем «власть живота» оборачивается для нас, зависит от того, кто именно захватил престол и давит на рычаги.
Во-первых, микробы работают как модераторы иммунитета. Они с детства «обучают» иммунные клетки хозяина толерантности к вторжениям извне.
Согласно «гигиенической гипотезе», именно это защищает нас от гипертрофированной иммунной агрессии. Если ребенок с детства недостаточно много контактирует с бактериями, то иммунные клетки атакуют не только жителей кишечника, но и другие части своего организма – это называется аутоиммунными реакциями. Аутоиммунные болезни и другие проявления гиперчувствительности иммунитета действительно реже развиваются у детей, которые носят в себе паразитов или чаще встречаются с инфекциями (например, оттого, что ходят в детский сад).
Во-вторых, от кишечных бактерий напрямую зависит, какие питательные вещества в конечном счете достанутся хозяину.
В-третьих, микробы активно общаются не только с кишечником, но и с другими органами человека. Для этого они используют нервные волокна в стенке кишечника: это болевые окончания и волокна блуждающего нерва, которые могут перенаправлять бактериальные сигналы в мозг. С их помощью микробы могут воздействовать на поведение хозяина, вызывая чувство удовлетворения или тревожности, тягу к той или иной еде и активный поиск еды или депрессию.
Долгожители заполучили себе бактерий-специалистов по серотонину, который часто называют «гормоном счастья». Вероятно, поэтому у них редко встречаются не только болезни Альцгеймера и Паркинсона, а еще тревожность и депрессия. При должном обращении микробы берегут не только кишечник, но и нервную систему хозяев.
У людей в возрасте от 99 до 104 лет состав бактерий иной, чем у группы долгожителей (105+ лет). Это выглядит удивительно, поскольку разница в возрасте между этими группами совсем небольшая, и можно было бы списать этот факт на погрешность измерения. Тем не менее, на 21 человека в возрасте от 100 до 104 лет приходится лишь один человек 105 и более лет, а значит, долгожители должны обладать какими-то особыми свойствами.
Судя по всему, долгожителем становится тот, кто умудряется поддерживать в своем кишечнике максимальное разнообразие. Удивительно, но оно не развязывает среди бактерий войну – наоборот, чем пестрее микробный состав, тем он стабильнее. А чем разнообразие ниже, тем слабее организм в целом.
Долгожители, возможно, могли бы поделитьсяс нами своими микробами. Фекальные трансплантации, то есть пересадки кишечных бактерий, уже проверяют на животных. Иногда успешно – например, известно, что перенос бактерий от молодых мышей в кишечник старых способен восстановить активность их иммунной системы и продлить жизнь ускоренно стареющим мышам (которые служат моделью человеческой прогерии).
Исследовании пересадка микробов в обратном направлении – от старых мышей молодым – заставила размножаться нервные клетки в молодом мозге. В этом же эксперименте ученые заодно обнаружили, что подсадные микробы выделяли большое количество бутирата – той самой жирной кислоты, которая стимулирует работу и человеческого мозга тоже.
Возможно, есть и другой способ завести себе полезных микробов– подкармливать бактерий их любимой едой. В таком случае решением может стать средиземноморская диета. В ней много овощей и фруктов, снабжающих микробов пищевыми волокнами, из которых в кишечнике получается бутират и другие жирные кислоты.
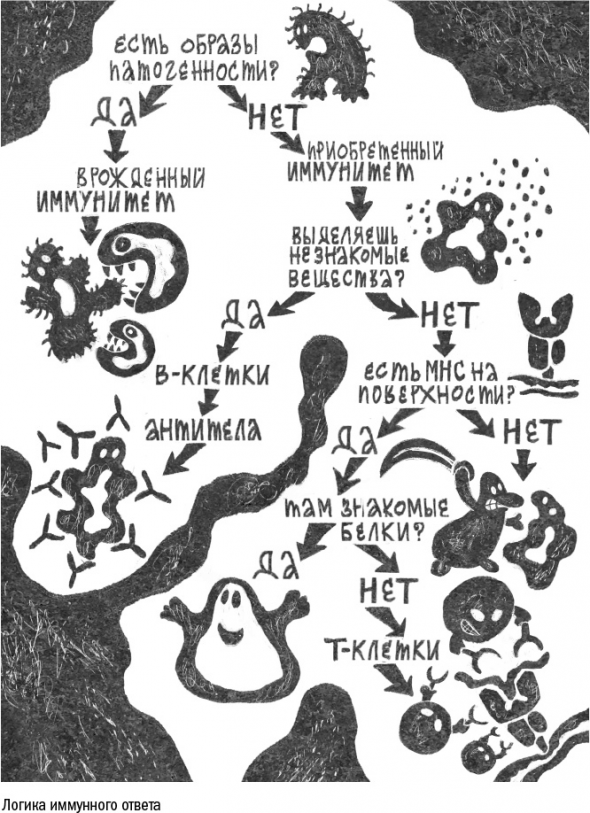
5. Иммунитет: Война с самим собой
Чтобы поддерживать спокойствие среди простых граждан – клеток в тканях, – иммунные клетки нередко берут на себя роль мусорщиков и спасателей, расчищая завалы в местах массовой клеточной гибели. Поэтому иммунной системе необходимо распознавать мертвые клетки и их обломки, чтобы определить место происшествия и забить тревогу.
Такие внутриклеточные вещества, которые служат сигналами тревоги, называют стрессорными, или аларминами. Это может быть АТФ (энергетическая «валюта» клетки), янтарная кислота (тоже внутриклеточный продукт обмена веществ) или белки, ответственные за упаковку ДНК в ядре.
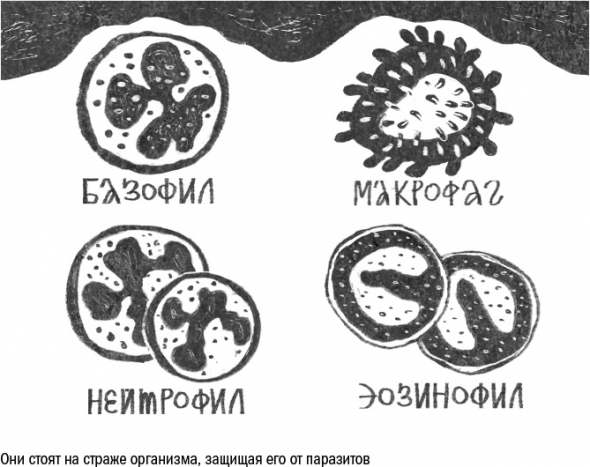
На чужеродные молекулы реагируют и профессиональные иммунные клетки, главная функция которых – разбор завалов и истребление паразитов. Это, например, макрофаги, клетки-пожиратели.
Другая группа иммунных клеток – гранулоциты – в присутствии образа патогенности выбрасывают в окружающее пространство вещества, токсичные для бактерий или червей. Вместе макрофаги и гранулоциты составляют систему врожденного иммунитета, который работает одинаково у всех здоровых людей и не зависит от их жизненного опыта и перенесенных ранее болезней.
Рис 54
каждое воспаление, каждая схватка с противником приближает старость ткани.
Этот феномен окрестилли «garb-aging» (дословно «мусорное старение», от английских слов «garbage» – мусор и «aging» – старение): клетки гибнут все чаще, межклеточный мусор копится, растет концентрация стрессорных молекул, на которые иммунная система реагирует как на паразитов. Вдобавок сенесцентные клетки выделяют белки SASP и завлекают иммунные клетки в ткани.
В результате в организме развивается хроническое воспаление, причем стерильное, поскольку никакие возбудители инфекций в этой битве не участвуют. В тканях задерживается все больше макрофагов, а в крови растет концентрация провоспалительных белков.
По аналогии с «мусорным старением» эту ситуацию можно назвать «воспаленным старением» – «inflammaging» (от английского слова «inflammation» – воспаление): старческое воспаление, старение как непрерывная война.
Незнакомец – значит, враг
Клетки врожденного иммунитета (гранулоциты и макрофаги) действуют, как отряд полицейских – с одной ориентировкой на всех. Те, кого нет в их черном списке, по умолчанию считаются друзьями. Такая система хорошо работает против регулярных набегов привычных бактерий, но оказывается бесполезна против незнакомых паразитов, ядов или опухоли – группы клеток, которые отличаются от соседей лишь несколькими мутантными белками.
Поэтому позвоночные животные завели себе еще один вид внутренних войск – Т- и В-лимфоциты, которые вместе отвечают за приобретенный иммунитет. Они ведут себя строго противоположным образом: реагируют на незнакомые молекулы и игнорируют привычные антигены. При этом у каждой клетки приобретенного иммунитета есть собственная ориентировка: она способна распознать только один антиген или похожие на него молекулы.
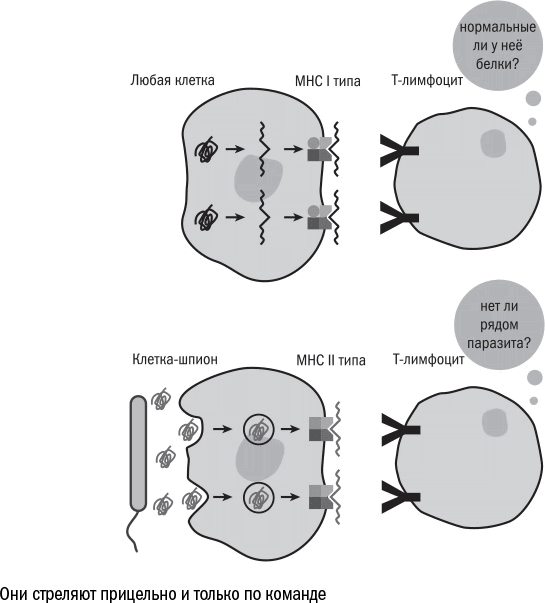
многие возрастные заболевания имеют среди прочего аутоиммунную составляющую, как, например, воспаление суставов или атеросклероз.
Иммунные клетки старого организма в чем-то напоминают некоторых старых людей, которые не способны усвоить новую информацию и по умолчанию злобно реагируют на незнакомцев. Такая стратегия поведения приводит к тому, что старый организм не способен больше узнать себя в зеркале иммунитета. Старение с точки зрения иммунной системы – это размывание границ между своим и чужим. Это состояние, когда «личность» организма изменяется быстрее, чем он успевает принять новый образ себя.
Становится некому образовывать новые клетки и выбирать из них наименее опасные, поэтому приобретенный иммунитет работает все хуже – например, пожилые люди тяжелее переносят сезонные инфекции, чем молодые.
Встретившись с антигеном, клетка размножается, создавая клон – группу клеток с одинаковой специализацией. Так формируется иммунологическая память.
Именно поэтому большинство людей, перенесших ветряную оспу, второй раз заболеть не могут: клетки памяти уничтожают вирус быстрее, чем он успевает размножиться.
Лучшее средство, которое мы сейчас знаем, чтобы успокоить свою жировую ткань, – средиземноморская диета. Под этим термином понимают самые разные режимы питания, но основные ее составляющие везде одинаковы: много овощей, фруктов, цельнозерновых злаков, оливкового масла и морской рыбы, небольшое количество животного жира, красного мяса, молочных продуктов
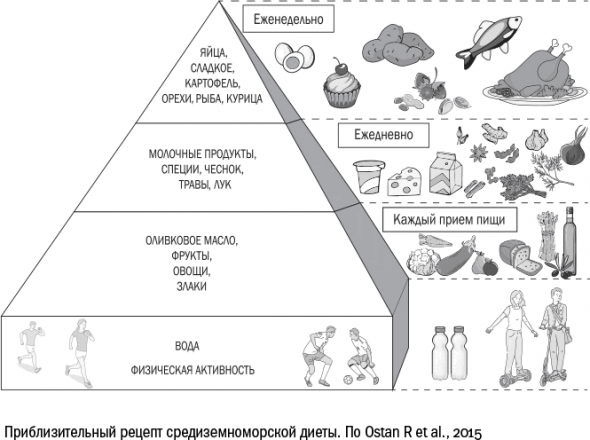
средиземноморская диета снижает воспаление за счет ненасыщенных жирных кислот.
6. Гормоны: Ставка на безопасность
Гормоны, как ствол дерева, соединяют и координируют работу разных частей человеческого тела: тканей, органов, клеток и даже микробов в кишечнике. Но чем больше веточек в системе, тем выше у нее шанс сломаться. То тут, то там возникают локальные сбои, которые система воспринимает как сигнал тревоги и пытается чинить, но на уровне всего тела это приносит больше вреда, чем пользы.
Примером многоступенчатой организации может служить гормональная реакция на стресс. На внутриклеточном уровне стресс – это атака токсичных веществ, а в масштабах целого организма – просто опасность.
Гипофиз в ответ на приказ сверху выделяет адренокортикотропный гормон (АКТГ),
который путешествует по крови до самых надпочечников – маленьких наростов на поверхности почек. И уже они выбрасывают в кровь главный стресс-гормон – кортизол, который, в свою очередь, включает аварийный режим во всех органах, от мышц до головного мозга.
Система «гипоталамус – гипофиз – надпочечники – кортизол» работает эффективно только благодаря отрицательной обратной связи.
маховик не раскручивается бесконечно, и организм получает только ограниченную «дозу стресса».
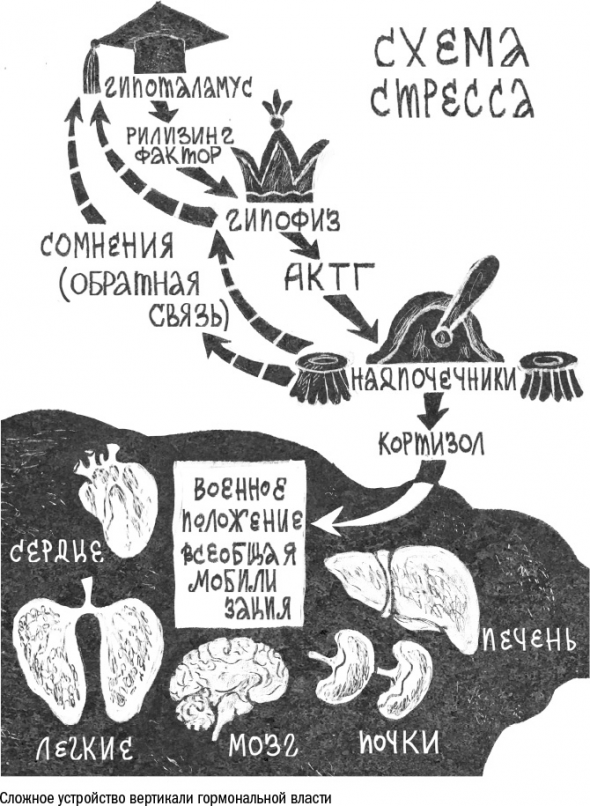
С возрастом обратная связь отключается, сирена ревет без перерыва на еду и сон, и количество кортизола в пожилом организме неуклонно растет.
Стареющий организм постоянно живет в стрессе, который он сам себе создал: незнакомые микробы, воинствующий иммунитет, вместо рабочих тканей – жир, сенесцентные клетки и рубцы. А это значит, что, как во время любой другой опасности, нужно запретить нецелевой расход ресурсов – например, на построение костей. Также не стоит тратить силы на рост мышц, лучше, наоборот, расщеплять в них белки и получать больше энергии. Наконец, в условиях внешней опасности нужно утихомирить внутренние распри, которые тоже отнимают силы, – поэтому и иммунная система лишается поддержки организма.
Поэтому, ткани изнашиваются: кости разваливаются (остеопороз), мышцы атрофируются (саркопения), а иммунная система сбавляет обороты.
Так или иначе, высокие уровни кортизола никому на пользу не идут. Поэтому неудивительно, что в крови долгожителей его, как правило, немного.
Мы знаем не так много способов избавиться от кортизола, но есть данные о том, что этому способствует активное вовлечение пожилых людей в жизнь общества. Вероятно, этим отчасти объясняются советы от обитателей «голубых зон» стараться жить до старости в кругу друзей и близких – секрет может быть в том, чтобы избавиться хотя бы от внешнего хронического стресса.
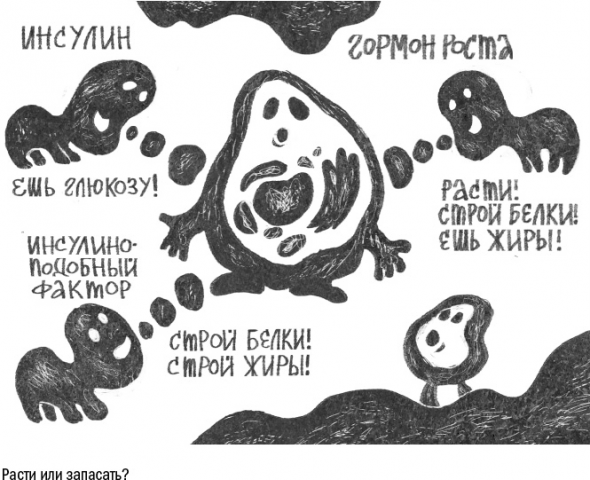
В 1990-е годы возникла идея гормональной терапии старения: в пилотном исследовании людям старше 65 лет в течение полугода вводили гормон роста, чтобы поддерживать их организм в «молодом» состоянии.
Оказалось, что у этой идеи есть немало побочных эффектов. На фоне скромных успехов (вроде роста мышц) у пациентов возникли боли в суставах и туннельный синдром (защемление нервных волокон). Кроме того, в некоторых случаях избыток гормона роста подавлял работу инсулина слишком сильно и вызывал в клетках нечувствительность к этому гормону. А это состояние уже может привести к диабету II типа.
Омолодить пожилых людей гормоном роста пока не удалось.
Половые гормоны обеспечивают не только репродуктивную, но и физиологическую молодость и держат в тонусе большинство неполовых органов.
Семенники в основном производят тестостерон и андрогены, а яичники – эстрогены.
Тестостерон у мужчин начинает снижаться с 35–40 лет, и за каждый год они теряют по 1–3 %.
Снижается либидо, не говоря уже о физиологической способности размножаться. Во-вторых, постепенно исчезают классические признаки «мужественности» и «женственности»: распадаются мышцы (саркопения), истончаются кости, перераспределяется жировая ткань (из подкожной клетчатки в висцеральный жир), а вместе с тем снижаются и физические возможности организма.
К 1935 году ученым удалось выделить и синтезировать тестостерон – и гормональная терапия начала восхождение на новый пик популярности. Врачи получили возможность вводить половые гормоны избирательно.
7. Кровь: Переливание молодости
В феврале 2019 года американский аналог Минздрава, FDA, предупредил пожилых американцев: не стоит участвовать в сомнительных программах по переливанию крови от молодых доноров.
Газеты выяснили цену: около 8000 долларов за одну капельницу.
Кровь служит универсальным каналом связи между разными тканями, поэтому с каждым вливанием человек получает не только гормоны, но еще и сигнальные вещества, факторы роста, про- и противовоспалительные белки – сразу весь комплект молекул, с помощью которых клетки общаются друг с другом. Поэтому теоретически мы могли бы использовать кровь для омоложения тела, даже не разобравшись до конца, какие именно вещества для этого по-настоящему важны.
В то же время использовать кровь в чистом виде довольно сложно: потребуется множество доноров, а пациенты столкнутся с разными побочными эффектами переливания.
Таким образом, с переливанием крови сложилась неоднозначная ситуация: в теории это очень удобный метод, который мог бы подействовать одновременно на работу отдельных клеток, целых тканей, иммунитета и желез, но на практике выяснить, как именно он действует, практически невозможно. И хуже всего то, что мы до сих пор не знаем, действует ли он на самом деле.
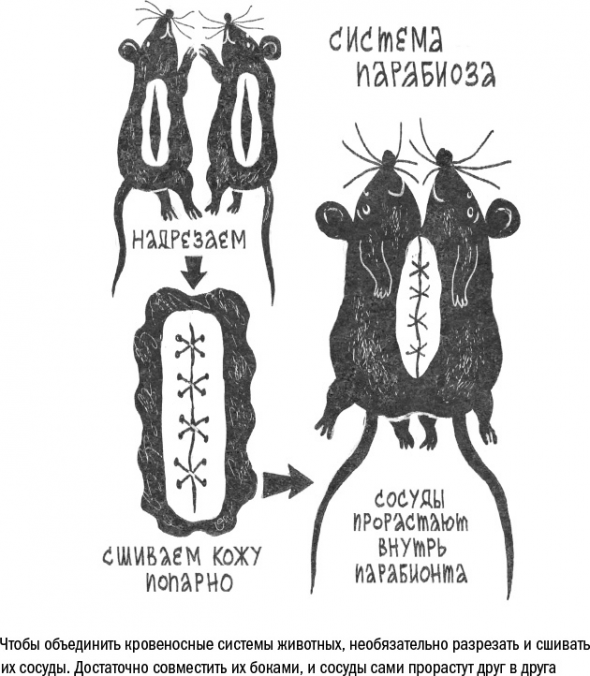
Систему из двух неразрывно соединенных организмов назвали парабиозом, дословно «жизнь около».
В середине ХХ века ученые обнаружили, что парабиоз может исцелить больное животное, если его соединить со здоровым сородичем. Это работало, например, для восстановления после радиотерапии (поскольку стволовые клетки крови здорового парабионта заселяли красный костный мозг больного) или для лечения некоторых форм мышечной дистрофии.
В 1972 году парабиоз попробовали использовать и для продления жизни. Для этого старое животное сшивали с молодым. Выяснилось, что старые животные в сцепке с молодыми живут действительно дольше, чем сами по себе. Обратное, впрочем, тоже оказалось верно.
Но, быть может, дело вовсе не в самой крови, а в распределении нагрузки на органы?
Через общее кровеносное русло стволовые клетки могли бы мигрировать в старые органы. Судя по всему, именно это и происходило в организме облученных мышей, которым парабиоз помогал восстановить здоровье: стволовые клетки из крови молодой мыши заселяли красный костный мозг старой мыши. То есть парабиоз стал фактическим аналогом трансплантации костного мозга.
вещество, которое предложили на роль переносчика молодости, – окситоцин – один из множества гормонов, содержание которых в крови с возрастом падает. Окситоцин производится в гипоталамусе и в основном регулирует процессы, связанные с размножением: возникновение сексуального влечения, беременность, роды и снижение тревоги в присутствии партнера или ребенка.
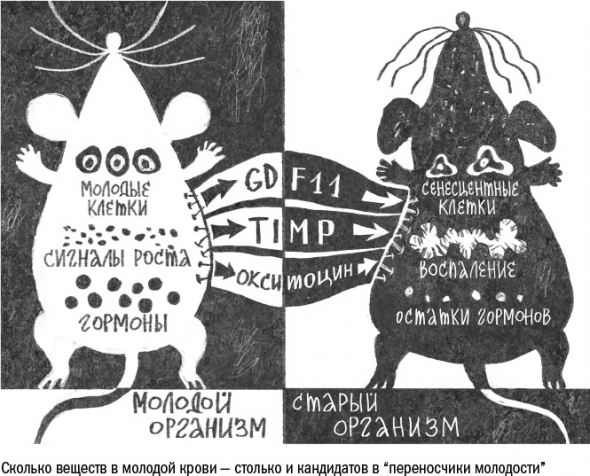
В подавляющем большинстве экспериментов здоровье старших парабионтов действительно менялось к лучшему. У них становились прочнее кости, медленнее копился жир и восстанавливалась поврежденная печень – все это говорит о том, что какие-то компоненты молодой крови можно рассматривать как лекарства от конкретных возрастных состояний.
Тем не менее ни в одном из этих экспериментов – кроме самых ранних работ 1972 года – не получилось настоящего продления жизни.
У нас все еще нет никаких веских причин полагать, что вливание молодой крови может продлить кому бы то ни было жизнь. Особенно если речь идет о здоровом человеке.
Сейчас рассчитывать на «пересадку молодости» едва ли стоит: сегодня гетерохроническое переливание крови – все еще один из инструментов для изучения старения, но никак не средство от него.
8. Возрастные заболевания: Бег по кругу
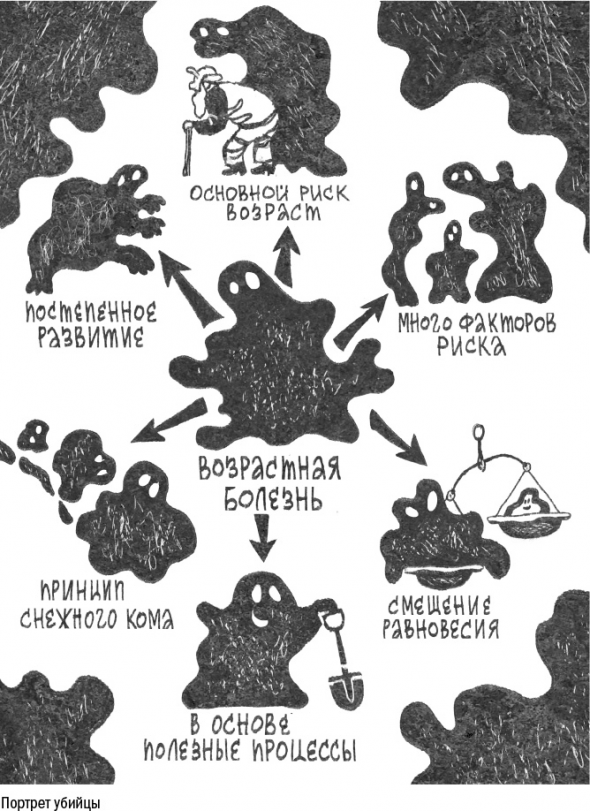
Возрастные болезни вырастают изнутри. Каждая из них складывается из множества процессов, которые, будучи в целом полезными, начинают работать в неправильном месте или с неправильной силой.
К возрастным заболеваниям относят все те, встречаемость которых растет со временем.
Есть основной круг заболеваний, которые обычно обсуждают в этом контексте. Это сердечно-сосудистые болезни (гипертония, инфаркт, инсульт, сердечная недостаточность, атеросклероз), опухоли, остеопороз (разрушение костной ткани), артрит (воспаление суставов), диабет, нейродегенеративные заболевания и хроническая обструктивная болезнь легких (воспаление, постепенно разрушающее ткань легкого). Именно их мы будем иметь в виду под «возрастными болезнями».
Замкнутый круг: возрастные болезни появляются вместе со старостью и в то же время сами приближают старость.
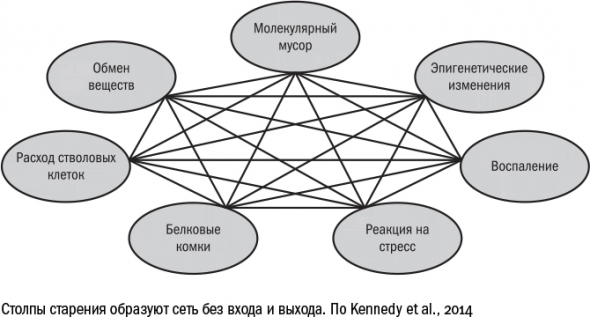
В 2014 году международная группа геронтологов выделила семь столпов, на которых зиждется старение и которые становятся в той или иной степени причинами всех возрастных болезней:
1. Повреждение макромолекул.
2. Потеря протеостаза. (Постоянство состава и функций клеточных белков)
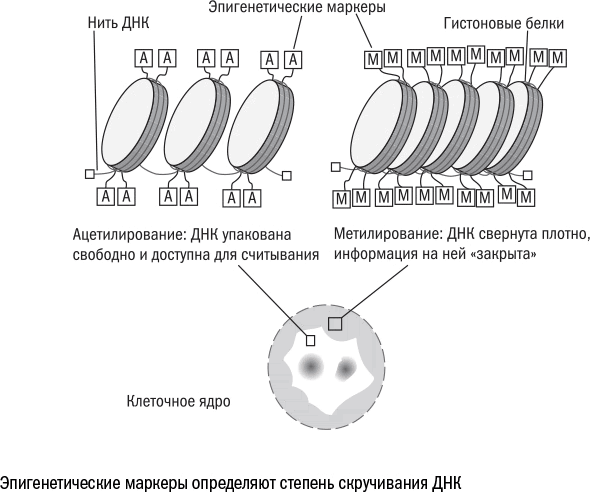
3. Эпигенетические изменения. (одни гены приобретают активность, другие теряют)
4. Истощение пула стволовых клеток
5. Изменение метаболизма. (изменения в обмене веществ)
6. Воспаление.
7. Адаптация к стрессу
Знакомьтесь: болезнь Альцгеймера
Среди множества возрастных болезней я выбрала одну, которая будет служить нам наглядным примером.
от нее страдает каждый третий старше 85 лет.
От нее до сих пор нет лекарства. Немногие зарегистрированные препараты лишь смягчают симптомы. Вкратце болезнь Альцгеймера выглядит так: в ткани головного мозга образуются амилоидные бляшки – агрегаты короткого белка бета-амилоида. Эти скопления токсичны для нейронов и разрушают связи между ними, а затем и сами клетки. Начинается нейродегенерация.
Человек постепенно теряет контроль за собственным телом.
От очага дегенерации зависит, как именно проявит себя деменция: в виде проблем со вниманием, памятью или настроением.
По оценкам ВОЗ, сегодня деменцией страдает около 36 миллинонов человек в мире, а к 2050 году станет больше 115 миллионов.
Однако 60–70 % всех случаев деменции завоевала себе именно болезнь Альцгеймера.
Современные лекарства от болезни Альцгеймераи не предотвращают гибель клеток и дегенерацию, а лишь смягчают симптомы.
Многие компании, занимающиеся разработкой лекарств (в том числе крупнейшие – Merck, Pfizer, Roche), уже капитулировали перед врагом.
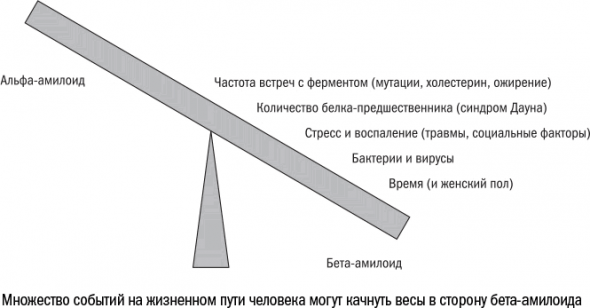
При ближайшем рассмотрении болезнь Альцгеймера оказывается не похожа на болезнь в классическом понимании этого слова. Это не отклонение и не патология, а результат действия тех самых механизмов, которые поддерживают нервную ткань в здоровом состоянии. Бета-амилоид, как настоящий литературный злодей, оказывается не просто ангелом в душе, но еще и неотъемлемой частью хрупкого мира, который он терроризирует. Именно поэтому мы не можем позволить себе избавиться от него совсем или разглядеть его приближение издалека.

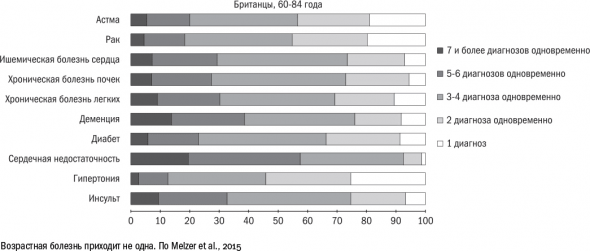
многие возрастные болезни возникают одновременно и хорошо уживаются в одном организме. По подсчетам британских медиков, среди людей от 60 до 84 лет почти 40 % страдают двумя-тремя заболеваниями, около 20 % – четырьмя-пятью.
Все возрастные болезни начинаются со смещения равновесия. В их основе лежит какой-то физиологический процесс или химическая реакция, которые меняют свое направление, и то, что раньше случалось редко, начинает происходить постоянно. При болезни Альцгеймера нейроны начинают производить бета-амилоид вместо альфа-амилоида. В начале образования опухоли рушится баланс между делением и покоем клеток. Аутоиммунные заболевания вроде артрита возникают, когда провоспалительных белков становится больше, чем противовоспалительных.
Тем не менее все эти процессы – лишь непомерно разросшиеся здоровые физиологические механизмы.
Поскольку в основе у них лежат полезные процессы, возрастные болезни можно рассматриваться не как разрушение, а как перестройку.
Большинство возрастных болезней мы не можем обратить вспять, остается только пробовать снять симптомы.
9. Биологический возраст: Старение здесь и сейчас
Есть множество параметров и маркеров, которые можно измерить: начиная с количества отдельных молекул в организме и кончая свойствами клеток и функциями органов. И чем больше признаков мы учитываем, тем точнее удается сделать прогноз. Сложная методика расчета становится черным ящиком, который выдает числа без объяснений.
Самое корректное определение сейчас звучит как-то так: «биологический возраст – это параметр, который предсказывает вероятность умереть лучше, чем хронологический возраст».
Критерии, которым должен соответствовать кандидат в маркеры биологического возраста:
1. Он должен предсказывать скорость старения, то есть риск умереть. И должен делать это лучше, чем хронологический возраст.
2. Он должен отражать базовые процессы, которые лежат в основе старения, а не последствия заболеваний.
3. Должен существовать способ измерить его несколько раз без вреда для человека или влияния на продолжительность жизни
4. Он должен работать не только для людей, но и для лабораторных животных
В 2001 году появился первый «индекс хрупкости», один из самых простых маркеров старения.
Исследователи проверили большую выборку людей на пять признаков хрупкости: ненамеренную потерю веса, слабую силу хвата рукой, медленную ходьбу, ощущение усталости и низкую физическую активность. Тех, кто подходил хотя бы по трем признакам, авторы критерия сочли хрупкими. У них действительно был выше риск ухудшения здоровья, госпитализации и смерти.
Каждый признак – это параметр, который:
а) является дефектом здоровья (а не свойством образа жизни, как, например, курение);
б) чаще возникает с возрастом;
в) встречается не реже, чем у 1 % людей в популяции.
Испытуемый получает свой «балл хрупкости», который растет по мере старения организма.
Индекс хрупкости – квинтэссенция медицинского подхода к старению, который рассматривает старость как совокупность возрастных болезней.
Однако с их помощью сложно предсказать что-либо, кроме риска смерти, поэтому для относительно здоровых людей от них немного толка. Помимо того, индексы хрупкости ничего не говорят нам о причине старения и измеряют лишь его последствия.
По подсчетам экспериментаторов, биологический возраст испытуемых, которым по паспорту 38 лет, может быть от 30 до 50.
ряд ученых используют принципиально другой подход к подсчету биологического возраста – искусственный интеллект. В США этим занимается группа исследователей под руководством ученого Алекса Жаворонкова.
Они тренируют искусственный интеллект на самых разных признаках старения. Например, в 2018 году они научили его измерять возраст человека по фотографии лица.
При этом наиболее значимой чертой оказались морщины в углу глаза.
В 2019 году группа Жаворонкова взялась за анализы крови. И снова искусственный интеллект определил возраст испытуемых с точностью до шести лет.
Следующие на очереди – микробы. Сопоставив относительное количество разных видов бактерий в кишечнике людей, нейронная сеть научилась определять возраст с точностью около четырех лет.
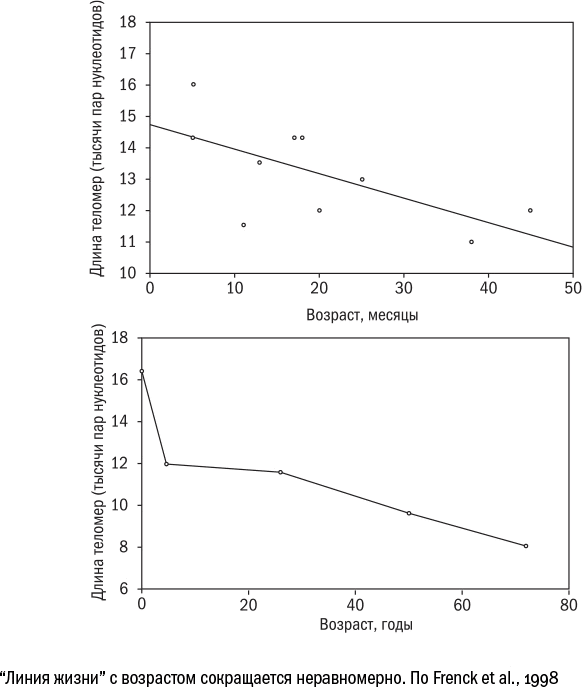
Ученые обращаются к привычным оракулам. Самый, наверно, древний из них – длина теломер. Теломеры – это концы хромосом, которые укорачиваются с каждым делением клеток, пока не достигают критически малой длины.
Теломеры кажутся удачной метафорой для срока клеточной годности.
Длина теломер неплохо вписывается в классические критерии маркера биологического возраста. Она коррелирует со смертностью и риском развития возрастных болезней. Она отражает внутренние причины, а не следствия старения. Ее легко измерить, не навредив пациенту, а способ измерения достаточно дешевый.
Тем не менее вера в предсказательную силу теломер постепенно сходит на нет.
Молекулярные часы
В качестве альтернативы теломерам в последнее время все чаще используют часы метилирования, или эпигенетические часы, – набор меток на ДНК. На нити ДНК висят метильные группы, которые влияют на степень скручивания разных ее участков. С возрастом они перестраиваются: где-то меток прибывает, а где-то они, наоборот, исчезают.
В 2013 году американец Стив Хорват построил систему определения возраста по метилированию ДНК, которую до сих пор иногда называют "часами Хорвата". Модель Хорвата предсказывает возраст с точностью до четырех лет.
Хорват откалибровал эпигенетические часы по настоящим биологическим маркерам, которые имеют непосредственное отношение к процессам старения. Так появилась система оценки возраста PhenoAge. Сейчас PhenoAge позволяет предсказать не только риск умереть, но и время, оставшееся до развития сердечно-сосудистых заболеваний и даже опухолей.
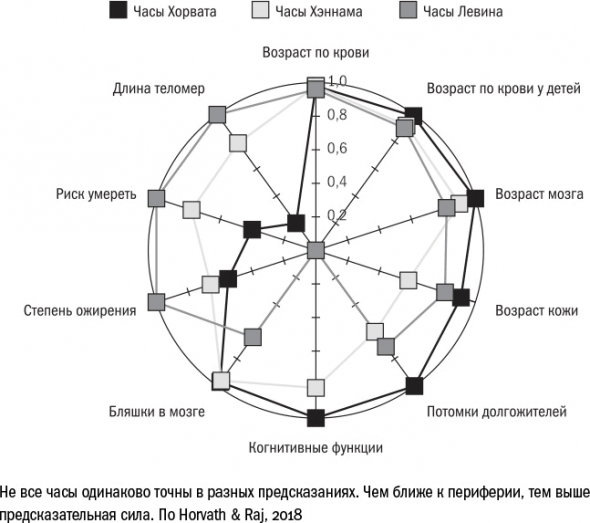
Число кандидатов в биомаркеры продолжает расти.
Когда же мы пытаемся найти один маркер для всего организма, сразу возникает вопрос: что именно мы измеряем на самом деле? Теломеры свидетельствуют о том, готовы ли клетки делиться, эпигенетические часы – о том, насколько хорошо клетка чинит свою ДНК или насколько хорошо поддерживает гены в раскрученном состоянии. Два этих маркера практически никогда не совпадают друг с другом в предсказаниях. Возможно, это говорит о том, что каждый маркер измеряет толщину своего собственного столпа старения, – и тогда бессмысленно пытаться увязать их воедино.
В следующей части мы попробуем найти золотую середину и поговорим о том, как поиск причин старения помогает узнать, что с ним можно сделать и какой рецепт «эликсира молодости» сегодня кажется наиболее правдоподобным.
 SEREGA20 июня 2020, 17:11Это заблуждение!!! Организм человека не стареет!!! (наивно)+1
SEREGA20 июня 2020, 17:11Это заблуждение!!! Организм человека не стареет!!! (наивно)+1 Obligacii20 июня 2020, 17:13Сильно, но не интересно…+1
Obligacii20 июня 2020, 17:13Сильно, но не интересно…+1 ML121020 июня 2020, 18:45перечитаю когда протрезвею, если успею, а так в закладку+1
ML121020 июня 2020, 18:45перечитаю когда протрезвею, если успею, а так в закладку+1 tim tim21 июня 2020, 00:58Главное — поддтирать жопу детскими использованными подгузниками. Маск уже скупает вагонами.+1
tim tim21 июня 2020, 00:58Главное — поддтирать жопу детскими использованными подгузниками. Маск уже скупает вагонами.+1